Nhiệt phân muối Nitrat được đánh giá là dạng bài tập khó của chương Nitơ – Photpho. Chúng không chỉ xuất hiện ở những câu hỏi trắc nghiệm lý thuyết mà còn “lăn lỏi” vào những bài toán khó. Tưởng chừng như gặp đi gặp lại nhiều lần thì các bạn sẽ nắm vững và ghi nhớ được chính xác, Thực tế thì không phải vậy, các bạn luôn bị nhầm lẫn về loại sản phẩm tạo thành sau khi nhiệt phân.
Đừng quá lo lắng! Ở bài viết này, gia sư Thành Tâm sẽ lần lượt hướng dẫn các bạn cách xác định sản phẩm và phân loại dạng bài tập nhiệt phân của muối Nitrat cụ thể nhất. Hãy cùng đọc và tham khảo nhé!
![[Nhiệt phân muối Nitrat]: Hướng dẫn, Phân loại bài tập chi tiết! [Nhiệt phân muối Nitrat]: Hướng dẫn, Phân loại bài tập chi tiết!](https://giasuthanhtam.com/wp-content/uploads/2021/08/nhiet-phan-muoi-nitrat.jpg)
Sơ lược về muối Nitrat
- Muối nitrat là muối của axit nitric.
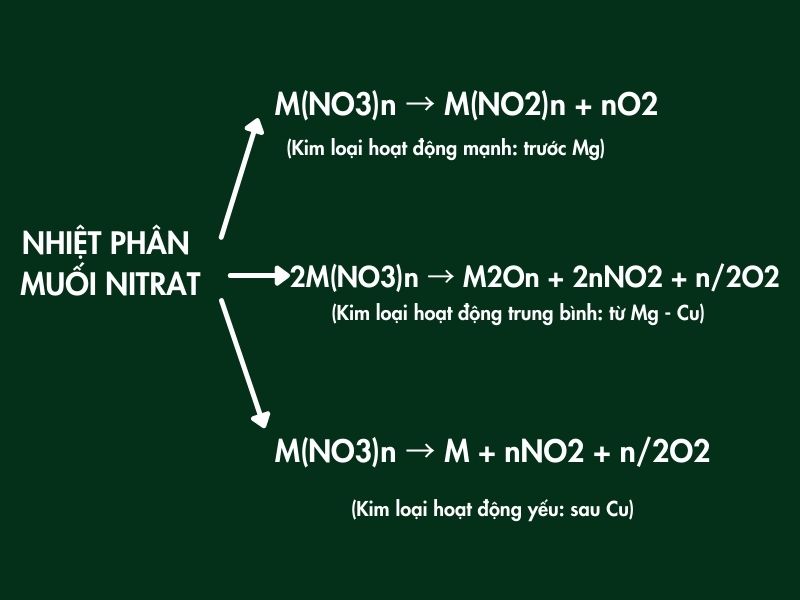
- Công thức tổng quát của muối nitrat là: M(NO3)n với n là hóa trị của kim loại M hoặc gốc NH4+.
- Tất cả các muối nitrat điều tan trong nước và là chất điện ly mạnh.
- Muối nitrat kém bền với nhiệt → dễ bị nhiệt phân.
Cách xác định sản phẩm nhiệt phân muối Nitrat
Vì muối Nitrat kém bền với nhiệt, do vậy, muối Nitrat dễ bị nhiệt phân. Sản phẩm sau khi nhiệt phân phụ thuộc vào gốc của cation. Cụ thể như sau:
Nhiệt phân muối Nitrat của kim loại đứng trước Mg (Li, K, Ba, Ca, Na)
Phương trình phản ứng tổng quát:
Muối Nitrat → Muối Nitrit + O2
M(NO3)n → M(NO2)n + nO2
Ví dụ: KNO3 → KNO2 + 1/2O2
Phản ứng nhiệt phân của muối nitrat của kim loại hoạt động trung bình từ Mg đến Cu
Phương trình phản ứng tổng quát:
Muối Nitrat → Oxit Kim Loại + NO2 + O2
2M(NO3)n → M2On + 2nNO2 + n/2O2
Ví dụ: Fe(NO3)2 → FeO + 2NO2 + O2
Nhiệt phân muối Nitrat của kim loại yếu (đứng sau Cu)
Phương trình phản ứng tổng quát:
Muối Nitrat → Kim Loại + NO2 + O2
M(NO3)n → M + nNO2 + n/2O2
Ví dụ: AgNO3 → Ag + NO2 + 1/2O2
Phản ứng đặc biệt
Các bạn học sinh cần phải lưu ý một số phản ứng nhiệt phân đặc biệt sau:
Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Phương pháp giải bài toán nhiệt phân muối Nitrat
- Khối lượng chất rắn ban đầu giảm chính bằng khối lượng khí đã sinh ra.
- Khí sinh ra sau phản ứng thường được dẫn qua nước, khi đó phản ứng xảy ra cụ thể như sau:
4NO2 + O2 + 2H2O → 4HNO3
Ví dụ: Nung nóng 66,2 gam Pb(NO3)2 thu được 55,4 gam chất rắn.
a. Tính hiệu của phản ứng phân hủy.
b. Tính thể tích các khí thoát ra (đktc) và tỷ khối của hỗn hợp khí thu được so với không khí.
Hướng dẫn giải:
Phản ứng:
Pb(NO3)2 → PbO + 2NO2 + 1/2O2
x 2x 1/2.x
mNO2 + mO2 = 46.2x + 32.0.5x = 66.2 – 55.4
Suy ra: x = 0.1 mol
a. Khối lượng của Pb(NO3)2 phản ứng là: mPb(NO3)2 = 0.1.331 = 33.1 gam.
- Hiệu suất của phản ứng nhiệt phân: H = 33.1/66.2.100 = 50%
b. Thể tích khí thoát ra: V = (0.1.2 + 0.1/2).22.4 = 5.6 lít
Phân tử khối trung bình của hỗn hợp khí: Mtb = (0.2.46 + 0.05.32)/25 = 43.2 gam → dhh/kk = 43,2/29 = 1,49.
Tổng hợp các bài toán nhiệt phân của muối Nitrat
1/ Hoà tan hết 18,8 gam hỗn hợp Fe; FeO; Fe3O4; Fe2O3 trong dung dịch HNO3 đặc nóng dư được 3,36 lít khí NO2 (đktc, sản phẩm khử duy nhất) và dd Y. Cô cạn dung dịch Y được m gam muối. Giá trị của m:
A. 64,9
B. 60,5
C. 28,1
D. 65,3
2/ Nhiệt phân không hoàn toàn 31,8 gam hỗn hợp LiNO3 và Fe(OH)2 (trong chân không) thì thu được 0,25 mol hỗn hợp hỗn hợp khí, ngưng tụ khí người ta thu được 0,1 mol khí còn lại. Và thấy bã rắn còn lại nặng 24,5 gam. Tính khối lượng mỗi chất rắn trong hỗn hợp sau phản ứng. Giả thiết các chất khí không hòa tan trong hơi nước, và hơi nước không phản ứng các oxit.
A. 1,5 gam Li2O, 11,6 gam FeO, 4,5 gam Fe(OH)2, 6,9 gam LiNO3.
B. 6 gam Li2O, 8 gam Fe2O3, 3,6 gam FeO, 4,5 gam Fe(OH)2.
C. 1,5 gam Li2O, 3,6 gam FeO, 4,5 gam Fe(OH)2, 6,9 gam LiNO3.
D. 1,5 gam Li2O, 8 gam Fe2O3, 12,5 gam Fe(OH)2, 6,9 gam LiNO3.
3/ Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng bao nhiêu?
4/ Cho 17,7 gam hỗn hợp Cu, Zn, Mg tác dụng với dung dịch HNO3 dư thu được dung dịch X, cô cạn dung dịch X thu được 67,3 gam muối khan (không có NH4NO3). Nung hỗn hợp muối khan này đến khối lượng không đổi thì thu được bao nhiêu gam chất rắn.
A.26,1
B. 25,1
C. 24,1
D. 23,1
5/ Đem nung hỗn hợp A gồm: x mol Fe và 0,15 mol Cu, trong không khí một thời gian, thu được 63,2 gam hỗn hợp B, gồm hai kim loại trên và hỗn hợp các oxit của chúng. Đem hòa tan hết lượng hỗn hợp B trên bằng dung dịch HNO3 đậm đặc, thì thu được 0,6 mol NO2. Trị số của x là:
A. 0,7 mol
B. 0,6 mol
C. 0,5 mol
D. 0,4 mol
KẾT LUẬN:
Gia sư dạy hóa lớp 11 của Thành Tâm hi vọng qua bài viết này, các bạn học sinh sẽ lần lượt giải đáp được những thắc mắc về lý thuyết và bài tập dạng nhiệt phân muối nitrat. Mỗi kiến thức mới điều có cái hay và cái khó riêng của nó. Điều quan trọng nhất là các bạn cố gắng học tập và tự rút kinh nghiệm trong quá trình học của mình.
Chúc các bạn học tốt !
Mọi chi tiết và thắc mắc vui lòng liên hệ về số hotline 0374771705 hoặc fanpage để được tư vấn và hướng dẫn.
TRUNG TÂM GIA SƯ THÀNH TÂM – NƠI CUNG CẤP GIA SƯ CHẤT LƯỢNG HÀNG ĐẦU TẠI HCM
Văn phòng đại diện: 35/52 Đường 44, Phường Hiệp Bình Chánh, Quận Thủ Đức, HCM
HOTLINE: 0374771705 (Cô Tâm)
>>>> Xem thêm:
- ANKAN là gì? Giải đáp “nhanh gọn” 5+ thắc mắc khi học Ankan
- Liên kết Hidro là gì? [Chi tiết] 5+ Điều cần biết về Liên Kết Hidro

Gia Sư Đà Nẵng: [Tư Vấn] Tìm Gia Sư Các Môn từ lớp 1-12!
Chi nhánh gia sư Đà Nẵng của Thành Tâm đã hoạt động hơn 6 năm, ...
Th11
[Chuẩn] Cách Học Tốt Môn Lịch Sử Lớp 12 Để Ôn Thi THPT
Môn Lịch Sử là một trong 3 môn xã hội được quy định trong kì ...
Th10
Kinh Nghiệm, Nội Dung Kiến Thức Ôn Thi Vào Lớp 10 Môn Văn 2023
Toán – Văn – Anh là bộ ba môn học mà Bộ GD-ĐT lựa chọn ...
Th10
Chia Đa Thức Cho Đơn Thức Lớp 8: Lý Thuyết & Bài Tập!
Chia đa thức cho đơn thức nằm ở phần chương 1 toán đại số của ...
Th10
[Tóm Tắt A-Z] Chương Trình Toán Lớp 10- Gia Sư Thành Tâm
Chương trình toán lớp 10 gồm những chuyên đề nào? Số lượng bài và tổng ...
Th9
[Đầy Đủ] Phương pháp luyện thi THPT quốc gia tổ hợp môn xã hội
Tổ hợp môn xã hội bao gồm Sử – Địa – GDCD – Văn – ...
Th9
Chương trình Toán lớp 11: Nội dung các chuyên đề Toán lớp 11
Nội dung chương trình Toán lớp 11 gồm những gì? Bao gồm các chuyên đề ...
Th9
[2023] Hợp chất hữu cơ là gì? Tính chất, phân loại hợp chất hữu cơ
Hợp chất hữu cơ là gì? Khái niệm, tính chất và cấu tạo phân tử ...
Th9